| 코로나 바이러스 S단백질의 정밀 구조 규명 | ||
|
||
 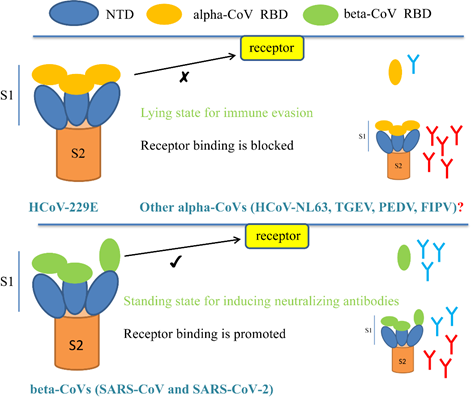 화중농업대학교 농업미생물학국가중점실험실 Peng Guiqing(授彭貴) 교수 연구팀과 상하이과학기술대학교 Liu Zhijie(劉志傑) 교수 연구팀은 코로나 바이러스 229E(HCoV-009E)의 표면 스파이크 단백질(S)의 근원자 해상도 구조를 분석하였다. 또한 스파이크 단백질의 두 가지 중간 형태를 포획하여 HCoV-229E가 숙주 세포를 침범하는데 필요한 동적 형태 변화를 규명하여 코로나 바이러스 백신 개발을 위한 새로운 아이디어를 제공했다. 해당 연구 성과는 국제학술 "Nature-Communication"에 온라인으로 게재되었다. 포유동물을 감염시키는 코로나 바이러스는 주로 Alpha속 바이러스(HCoV-229E, PEDV, TGEV, FIPV 등)와 Beta속 바이러스(SARS-CoV, SARS-CoV-2, MERS-CoV) 등이 있다. 코로나 바이러스 스파이크 단백질(S)은 동형삼량체로 바이러스 침입을 매개하고 중화 항체 생성을 유도함에 있어서 핵심적인 역할을 하다. 연구에 따르면 Beta 코로나 바이러스 S단백질의 수용체 결합 구역(RBD)은 "lying"에서 "standing" 형태로의 전환이 존재하여 세포 수용체와의 결합을 완성한다. 그러나 Alpha 코로나 바이러스 S단백질 RBD가 형태 전환을 통해 수용체와 결합하는 방식은 아직 밝혀지지 않았다. 연구팀은 단일입자 극저온전자현미경 3차원 재구성 방법을 통해 HCoV-229E 스파이크 단백질의 두가지 형태 구조를 분석했다. 형태1은 "가늘고 긴" 구조이고 3개의 수용체 결합 영역(RBD)은 모두 "lying" 상태이며 입체 장애로 인해 수용체 APN와 결합할 수 없다. 해당 형태는 수용체 결합의 비활성 상태(closed state)이다. "짧고 뚱뚱한" 새로운 형태도 발견되었는데 RBD 배열이 더 느슨하며 “standing” 상태로의 전환에 더 유리하여 수용체와 결합한다. 해당 발견은 동물의 건강을 심각하게 위협하는 기타 Alpha 코로나 바이러스(PEDV, TGEV, FIPV)에로 확장시킬 수 있다. 또한 숙주 세포 침입의 분자 메커니즘을 확인하고 새로운 백신과 약물을 개발하기 위한 중요한 과학적 의미가 있다. 이를 기반으로 연구팀은 코로나 바이러스 S-삼량체와 S-RBD를 설계 및 발현시키고 면역 효과 평가를 통해 코로나 바이러스 서브유닛 백신 개발을 위한 새로운 아이디어를 제안했다. Appha-코로나 바이러스(HCoV-229E, PEDV 등)에서 S-삼량체 가 S-RBD보다 코로나 바이러스 버스유닛 백신으로 더 적합하고, Beta-코로나 바이러스(SARS-CoV와 SARS-CoV-2)에서 S-삼량체와 S-RBD가 모두 코로나 바이러스 서브유닛 백신으로 사용될 수 있다. 정보출처 : http://news.sciencenet.cn/htmlnews/2021/1/452384.shtm |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
