| 시신경절세포 재생 전략으로 생쥐 시력 회복 | ||
|
||
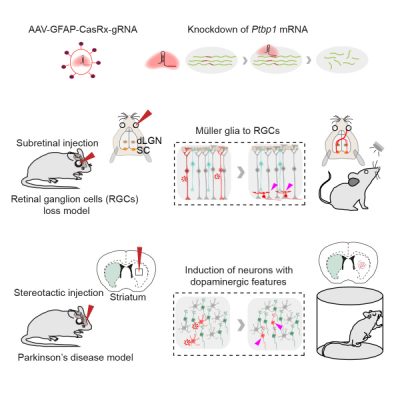 중국과학원 뇌과학지능기술탁월혁신센터 양후이(楊輝) 연구팀은 새로 개발한 RNA 표적화 CRISPR 시스템 CasRx를 이용해 망막 뮐러아교세포(muller glial cell)에서 Ptbp1 유전자의 발현을 녹다운(knock-down)시킴으로써 최초로 성체 시신경절세포 재생을 구현해 영구적 시각손상 모델 생쥐의 시력을 회복시켰다. 해당 기술은 또한 매우 고효율적이고도 특이적으로 선조체 내 성상교세포를 도파민 뉴런으로 전환분화(transdifferentiation)시킬 뿐만 아니라 파킨슨병 증상을 기본적으로 제거할 수 있다. 해당 연구는 다수 신경퇴행성질환 치료에 새로운 경로를 제공하였다. 해당 성과는 "Cell"에 게재되었다. CasRx는 표적화 Ptbp1 mRNA 분해를 통해 Ptbp1 유전자 발현을 하향 조절한다. AAV-GFAP-CasRx-Ptbp1 망막하 주사는 망막 뮐러아교세포를 시신경절세포로 특이적으로 전환분화시킬 수 있고 해당 시신경절세포는 정확한 뇌영역과 기능성 연계를 구축할 수 있으며 영구적 시각손상 모델 생쥐의 시력을 향상시킬 수 있다. 선조체에 AAV-GFAP-CasRx-Ptbp1를 주입하면 성상교세포를 도파민 뉴런으로 특이적으로 전환분화시킬 수 있기에 파킨슨병 모델 생쥐의 운동증상을 기본적으로 없앨 수 있다. 인간의 신경계는 수백 내지 수천 종의 다양한 뉴런 세포를 포함한다. 성숙된 신경계 뉴런은 일반적으로 재생되지 않는데 사망하기만 하면 돌이킬 수 없다. 뉴런의 사망은 알츠하이머병, 파킨슨병 등과 같은 다양한 신경퇴행성질환을 초래할 수 있다. 통계에 따르면 현재 세계적으로 약 1억여 명이 신경퇴행성질환을 앓고 있는데 노령화가 심화됨에 따라 환자수도 증가하고 있다. 흔히 볼 수 있는 신경성질환 중 시신경절세포 사망으로 인한 영구적 실명 그리고 도파민 뉴런 사망으로 인한 파킨슨병 이 두 가지가 더욱이 특별한데 양자 모두 특수 유형의 뉴런 사망에서 비롯된다. 연구에 의하면 허혈성 망막질환, 녹내장 등 다양한 안질환 모두 시신경절세포의 사망을 유발해 영구적 실명을 초래할 수 있다. 파킨슨병의 발생은 뇌내 흑질(substantia nigra) 영역 중 도파민 뉴런의 사망에서 비롯되는데 이는 도파민의 흑질-선조체 경로를 통한 대뇌 다른 영역 선조체로의 수송 불능을 초래한다. 성체에서 상기 두 가지 특이한 유형의 뉴런을 어떻게 재생시킬지는 과학자들의 연구과제이다. 연구팀은 체외 세포계(cell line)에서 Ptbp1 발현을 고효율적으로 억제하는 gRNA를 선별한 다음 뮐러아교세포를 특이적으로 표지하며 또한 뮐러아교세포에서 CasRx를 발현시키는 시스템을 설계하였다. 모든 요건을 AAV에 패킹시킨 후 망막하 주사를 통해 성체 생쥐 뮐러아교세포 중 Ptbp1 유전자 발현을 특이적으로 하향 조절하였다. 약 1개월 후 연구팀은 망막 시신경절세포층에서 뮐러아교세포로부터 전환분화된 시신경절세포를 발견하였다. 해당 시신경절세포는 정상적인 세포처럼 광자극 조건에서 상응한 전기신호를 발생할 수 있을 뿐만 아니라 시신경을 통해 대뇌 중 정확한 뇌영역과 기능성 연계를 구축할 수 있으며 또한 시각신호를 대뇌에 전달함을 발견하였다. 시신경절세포 손상 생쥐 모델에서 연구팀은 전환분화된 시신경세포가 영구적 시각손상 생쥐로 하여금 빛에 대한 민감성을 재구축하도록 함을 발견하였다. Ptbp1 유도 아교세포의 뉴런으로의 전환분화 치료 잠재력을 더한층 발굴하기 위해 연구팀은 해당 전략은 선조체 중 성상교세포를 도파민 뉴런으로 특이적이고도 고효율적으로 전환분화시킬 수 있고 또한 해당 도파민 뉴런은 흑질 중 도파민 뉴런과 유사한 특성을 나타낼 수 있음을 입증하였다. 행동학 테스트에서 상기 전환분화 유래 도파민 뉴런은 흑질에서 상실된 도파민 뉴런의 기능을 보충함으로써 파킨슨 모델 생쥐의 운동장애를 정상 생쥐에 가까운 수준으로 역전시킬 수 있음을 발견하였다. 정보출처 : http://www.cas.cn/cm/202004/t20200409_4740636.shtml |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
