| 활성 상태 포르밀화 폴리펩티드 리간드 FPR2의 신호 전달 메커니즘 분석 | ||
|
||
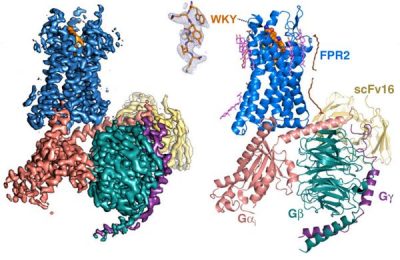 중국과학원 상하이약물연구소 쉬화창(徐华强) 연구팀은 미국 피츠버그대학교(University of Pittsburgh) Cheng Zhang 연구팀과 공동으로 미국 밴 앤델 연구소(Van Andel Institute)의 냉동전자현미경 플랫폼을 기반으로 염증 유발성 폴리펩티드 리간드 WKYMVm 활성화 조건에서 FPR2-Gi 신호 복합체의 냉동전자현미경 구조(3.17A)를 분석했다. 아울러 컴퓨터 시뮬레이션 방법을 결합하여 FPR2의 활성화 메커니즘을 해석하였으며 FPRs 수용체 패밀리가 포르밀화 폴리펩티드 리간드를 식별하는 잠재적인 보수 식별 모드를 제안함으로써 FPRs의 리간드 식별 메커니즘, 다운스트림 신호 단백질 Gi와의 결합 모드 파악 및 FPR2를 표적으로 하는 관련 약물 설계 개발에 견고한 구조적 및 이론적 기반을 마련했다. 해당 성과는 "Nature Communication"에 온라인으로 게재되었다. 세균과 숙주의 미토콘드리아 단백질에는 대량의 포르밀화된 폴리펩티드가 존재하며 이들의 공통된 특징은 단백질 서열의 N 말단 메티오닌이 포르밀화에 의해 수정되어 인체에서 포르밀화 폴리펩티드 수용체(Formyl-peptide receptors, FPRs)라 불리는 G단백질 연결 수용체 (GPCRs)에 의해 식별됨과 아울러 관련 면역 세포의 행위 변화를 유발함으로써 인체의 외인성 병원체 미생물에 대한 고유의 면역 방어를 달성하고 체내의 노화 또는 손상된 세포를 제거한다. 구조적으로 Class A류 GPCR에 속하는 FPR은 FPR1, FPR2 및 FPR3으로 구성되며 주로 호중구, 대식세포 및 백혈구 등에 존재한다. 그 중, FPR2는 모든 GPCR에서 전형적인 복잡한 리간드 종류이다. 광범위한 유래의 포르밀화 펩타이드 리간드를 모식화 식별할 뿐만아니라 HIV바이러스 유래의 폴리펩티드, 베타아밀로이드, 케모카인 등과 같은 일련의 구조와 기능이 다양한 비포르밀화 단백질 리간드도 식별할 수 있다. 포르밀화 폴리펩티드 리간드를 포함한 대부분의 리간드는 FPR2를 활성화시킨 후, 면역세포의 화학주성과 이동 및 후속적인 염증 반응 발생을 매개하지만, FPR2는 내인성 단백질 리간드(Annexin A1) 및 지질 리간드(LXA4, Resolving D1 등)에 의해 활성화되어 염증 반응의 제거를 매개하고 신체를 보호하는 역할을 한다. FPR2는 기능의 복잡성으로 인해 염증, 알츠하이머병, 에이즈, 신종 인플루엔자A 등을 포함한 관련 약물 개발의 중요한 약물 표적으로 되고 있다. FPR2 유전자가 발견되고 복제된 이후 30년 동안 FPR2에 대한 많은 생화학적 연구가 진행되었지만 관련 구조 결핍 때문에 FPR2의 활성화 메커니즘 및 다운스트림 신호 단백질과의 결합 방식은 계속 미지의 상태에 머물러 FPR2 표적 약물 개발을 크게 제한하고 있다. 연구팀은 FPR2가 방대한 양친성 리간드 결합 포켓을 보유함을 발견했다. 또한 기존에 알려진 폴리펩티드 결합의 케모카인 GPCR과는 달리, WKYMVm이 C-말단이 안쪽으로 향하는 모드로 FPR2에 완전히 삽입되어 FPR2로 하여금 보수적인 아미노산잔기 W2546.48과 직접 상호작용하고 양친성 포켓에 내장되도록 한다. 컴퓨터 시뮬레이션 분석 결과, FPR2의 세포외 영역은 아주 활성화되었다. 해당 특성은 FPR2가 다양한 화학 구조의 리간드와 결합하는 능력을 보유함을 말해준다. 연구팀은 또한, FPR2-WKYMVm의 구조 및 FPR2와 FPR1 간 69%의 높은 서열 유사성에 기반하여 FPR1의 3차원 모델을 구축하고 FPR1/FPR2 결합 포르밀화 리간드 모드에 대한 시뮬레이션 분석과 기능 테스트를 진행했다. 그 결과, 포르밀화 리간드는 N 말단이 안쪽을 향하는 형식으로 수용체에 결합되고 N 말단 포르밀 시뮬레이션 WKYMVm의 C 말단 D-Met는 FPR1/FPR2 리간드 결합 포켓 내부의 D1063.33, R2015.38 및 R2055.42 등 3개 아미노산잔기가 형성한 극성 포켓과 상호작용한다. 상기 3개의 보수적 아미노산은 FPRs모드를 구성하여 포르밀화 폴리펩티드 리간드의 중요 구조 모티브를 식별하고 포르밀화 폴리펩티드 리간드가 정확한 형태로 FPR와 결합하고 FPR을 심층 활성화하도록 한다. FPR2와 Gi는 Gαi의 α5 나선과 FPR2가 형성한 홈, Gαi의 αN-β1과 β2-β3 왜곡과 수용체의 ICL2, 및 Gβ와 FPR2의 Helix 8등 3가지 상이한 결합 계면이 존재한다. 해당 결과는 GPCR이 다운스트림 G 단백질과 결합하는 패턴의 보수성과 다양성을 나타낸다. 정보출처 : https://mp.weixin.qq.com/s/Lki6WtPz0Y11soI51aL9qg?tdsourcetag=s_pctim_aiomsg |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
