| 생물대분자 구조 해석에서 냉동전자현미경의 해상도 한계 확장 | ||
|
||
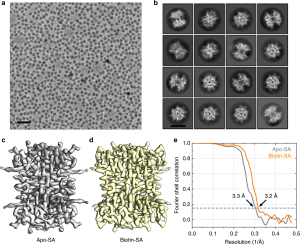 최근 칭화대학 왕훙웨이(王宏偉) 연구팀은 구면수차 보정기-전압 위상판 냉동전자현미경 이미징시스템으로 사진속 단백질 입자의 콘트라스트를 대폭 향상시킴과 아울러 후기 3차원 재구성에 필요량의 고해상도 구조정보를 보존했다. 이에 기반해 연구팀은 자체적으로 개발한 단일층 큰 단결정 그래핀 파인더그리드(finder grid)를 사용해 단백질 샘플을 냉동시킴으로써 친수화 그래핀 표면에 흡착해 있는 단백질 분자가 기액 계면에 의한 분자 구조의 변화를 피면함과 아울러 보다 완전한 구조정보를 보존했다. 연구팀은 2가지 기술의 장점을 결합해 52kDa 분자량의 스트렙타비딘(streptavidin) 단백질, 결합/미결합 소분자 비오틴(biotin) 등 2가지 상태의 근원자 해상도(near atomic resolution) 구조를 각각 획득했다. 이로써 단일입자 기술을 사용한 근원자 해상도의 단백질 구조 해석에서 분자량 최소치 신기록을 세웠고 또한 해당 기술의 응용한계를 넓혔다. 해당 연구 성과는 현존 단일입자 샘플에서 기액 계면이 단백질 분자의 입자성질에 미치는 핵심적 증거를 제공함으로써 전통이론을 유력하게 보완했고 또한 미래 방법론의 발전을 적극 추진하는 역할을 한다. 해당 연구성과는 “Nature Communications”에 온라인으로 게재되었다. 냉동전자현미경(cryo-EM) 단일입자분석 기술은 이미 구조생물학의 주요 구조해석 방법으로 자리매김했다. 특히 막단백질 구조해석에서 날로 중요한 역할을 하고 있다. 기존의 냉동전자현미경 단일입자 기술은 분자량이 300kDa 이상이고 생화학 성질이 안정적인 단백질을 근원자 해상도(약 3Å 수준)에서 쉽게 해석할 수 있다. 하지만 냉동 샘플에서 소분자량 단백질(일반적으로 200kDa 이하) 입자의 콘트라스트 부족 등 관계로 기존의 기술 수단을 통한 소분자량 단백질 고해상도 해석은 매우 어렵다. 정보출처 : http://www.most.gov.cn/gnwkjdt/201907/t20190702_147436.htm |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
