| 철단백질 탐침의 간암 진단 및 치료 메커니즘 규명 | ||
|
||
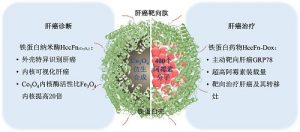 중국과학원 생물물리연구소 옌시윈(閻錫蘊) 연구팀은 앞서 인간 철단백질을 이용해 종양 표지분자 TfR1의 특성을 특이적으로 인식했고 또한 나노효소를 종양 부위에 정확하게 수송함과 아울러 효소촉매를 통해 활성산소(ROS)를 생성함으로써 종양을 살상시켰다(Nature Communications 2018). 이를 기반으로 연구팀은 간암을 특이적으로 표적화 및 시각화함과 아울러 간암세포를 살상시킬 수 있는 신형 철단백질 탐침을 설계했다. 해당 연구에서 연구팀은 다양한 종속에서 유래한 철단백질을 선별해 최종 파이로코쿠스 퓨리오소스(Pyrococcus furiosus) 철단백질 탐침이 다음과 같은 3가지 특성을 보유함을 입증했다. 1) 간암 식별. 유전자 공학적 수단을 통해 표면에 간암 표적화 펩타이드 SP94를 구현했다. 후자는 간암세포 표면의 포도당조절단백질78(GRP78) 수용체와 특이적으로 결합한다. 2) 내강에 Co3O4 나노효소를 담지할 경우 철단백질 탐침은 페록시다아제 기질을 촉매해 간암세포를 시각화한다. Co3O4 나노효소의 촉매 효율은 철계 나노효소의 20배로서 간암 검출 민감도를 향상시켰다. 3) 내강에 아드리아마이신을 담지할 경우 철단백질 약물은 간암세포를 정확하게 살상한다. 파이로코쿠스 퓨리오소스 철단백질은 400개 아드리아마이신 분자를 담지할 수 있는데 이는 인간 철단백질 약물담지량의 10배이고 항체 약물담지량의 50~100배이다. 간암 진단 영역에서 424건 임상 간세포암 조직 검출 사례를 통해 Co3O4 담지 철단백질 나노효소 HccFn(Co3O4)은 간세포암 조직과 정상 간조직을 구분할 수 있다. 그 민감도는 63.5%, 특이성은 79.1%에 달한다. 해당 결과는 임상용 간암 표지자 α페토프로테인(AFP)과 비슷하다. 심층적 병리 분석에 의하면 HccFn(Co3O4) 탐침 검출 결과는 간세포암 환자 예후와 연관이 있는데 이는 해당 탐침이 간세포암 환자 예후 판단의 잠재적 공구가 될 수 있음을 의미한다. 간암 치료 영역에서 파이로코쿠스 퓨리오소스 철단백질 약물(HccFn-Dox)은 간암 보유 누드마우스 모델에서 간암 및 폐전이 후의 간암조직을 고효율적으로 살상하는 반면 정상조직에 대한 부작용은 뚜렷하지 않았다. 그 작용 메커니즘은 다음과 같다. 철단백질 표면의 간암 표적화 펩타이드 SP94는 GRP78 수용체와의 특이적 결합을 통해 GRP78은 세포내섭취(endocytosis)를 유도한 다음 간암세포 리소좀에 진입한다. 철단백질은 리소좀의 산성환경에서 분해되어 아드리아마이신을 방출하고 후자는 간암세포를 살상시킨다. 해당 연구는 간암 진단 및 치료에 새 아이디어를 제공했다. 상기 두 성과는 "ACS Applied Materials & Interfaces"와 "Theranostics"에 각각 게재되었다. 정보출처 : https://mp.weixin.qq.com/s/v4cvG9K94ur5DxIoG1ohaQ |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
