| 생물화학·세포생물학연구소, 면역계 "불활성화" 분자 PD-1의 새 조절메커니즘 발견 | ||
|
||
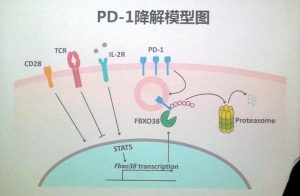 최근, 중국과학원 생물화학·세포생물학연구소 분자생물학국가중점실험실 쉬천치(許琛琦) 연구팀은 최초로 인간 면역계 "불활성화" 분자 PD-1의 분해 메커니즘 및 해당 메커니즘이 종양 면역반응에서의 기능을 규명하였다. 해당 성과는 2018년 11월 29일 "Nature"에 온라인으로 게재되었다. T세포는 인체 면역계의 일부분이자 생체 건강의 중요한 "보호자"로서 체내 돌연변이세포를 제때에 식별·제거하여 종양의 발생을 방지한다. 그러나 부분 종양세포는 PD-1 분자 활성화를 통하여 면역계를 "불활성화"시켜 T세포에 의한 살상을 회피하고 종양의 발생 및 진행을 유발한다. 임상에서 PD-1 통로를 차단하는 항체 약물로 환자의 항종양 면역기능을 회복시켜 종양치료 목적에 도달할 수 있다. 해당 종류 약물은 이미 개발되어 폐암, 간암, 신장암 등 10여 종 종양치료에 이용되고 있다. PD-1의 발견자 TasukuHonjo는 해당 성과로 2018년 노벨생리의학상을 수상하였다. 그러나 PD-1이 종양 미세환경에서 "활성화"되는 원인을 해석하지 못하였다. 쉬천치 연구팀은 줄곧 T세포의 기능 조절 연구를 수행했으며 첫 단계에 T세포 핵심 수용체 TCR과 CD28의 활성화 메커니즘 및 콜레스테롤 대사가 T세포 항종양 기능에 대한 조절 작용(Nature 2013, Nature 2016, Nature Structural & Molecular Biology 2017)을 발견했다. 해당 연구에서 연구팀은 새 관점으로 PD-1의 조절 메커니즘을 연구하여 PD-1은 정상 T세포에서 신속한 분해과정이 존재함을 발견함과 아울러 그 중에서 핵심 작용을 일으키는 단백질 분자 FBXO38를 감정하였다. FBXO38는 PD-1에 분해를 유도하는 마커를 첨가할 수 있고 분해 마커에 첨가된 PD-1은 세포 회수장에 이송되어 프로테아좀에 의해 분해되며 따라서 PD-1의 정상 수준 유지가 보장되어 T세포 기능 발휘에 영향을 미치지 않는다. 그러나 종양에 의해 "포위"된 T세포에서 FBXO38 "활성화" 수준은 아주 낮아 PD-1의 정상적인 분해를 유발할 수 없기에 T세포는 응당 분해해야 하는 PD-1에 의하여 "구속"되어 항종양 면역반응이 억제된다. 심층적 연구 결과, 인터류킨 2는 FBXO38의 "활성화" 수준을 회복시켜 PD-1이 "정상 지표"로 되게 하며 따라서 T세포의 항종양 기능이 향상된다. 인터류킨 2는 이미 흑색종 및 신장암을 치료하는 임상약물로 되었으며 PD-1에 대한 조절은 인터류킨 2의 임상효과 배경에서의 메커니즘이다. 그러나 인터류킨 2는 부작용이 크기에 임상에서 광범위하게 응용되지 못하고 있다. 연구팀은 계속하여 인터류킨 2의 약제형 및 사용량을 최적화함과 아울러 인터류킨 2의 기타 약물과의 병용치료 전망에 대한 연구를 지속적으로 수행할 예정이다. 해당 연구는 중요한 약물 표적 PD-1의 새로운 조절 메커니즘을 규명했는데 이는 종양 면역응답을 더욱 심층적으로 연구하여 새로운 종양 면역치료 방법을 설계하는데 도움이 된다. 정보출처 : https://mp.weixin.qq.com/s/4vlv_kSZO-ozR6uRtgqyLw |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
