| 푸단대, 장수유전자 SIRT3의 결직장암 조절 메커니즘 규명 | ||
|
||
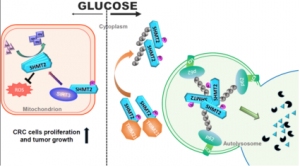 최근 푸단(復旦)대학 생명과학학원 위웨이(餘巍) 연구원과 상하이교통대학 의학학원 부속신화병원 추이룽(崔龍) 교수 연구팀은 공동으로 장수유전자 SIRT3의 단일 탄소 단위 대사효소 조절을 통한 결직장암 발생 관여 관련 새로운 분자 메커니즘을 발견하여 결직장암 치료용 표적지향성 약물 개발에 이론적 토대를 마련하였다. 관련 연구 성과는 최근 "Nature Communications"에 온라인으로 게재되었다. 결직장암은 세계적으로 가장 흔한 일종의 소화관 악성 종양이다. 국민 생활수준의 향상과 생활 방식의 변화에 따라 결직장암 발병률 및 사망률은 해마다 상승하는 추세를 보이고 있다. 중국은 세계에서 연간 결직장암 발병 건수가 가장 많은 나라이다. 현재 결직장암 치료는 주로 수술적 절제와 화학방사선요법 보조치료를 병행하는 등 기법에 의존한다. 결직장암 발병 메커니즘 및 질병 진행에 영향을 미치는 유전, 후성유전, 대사 등 요인으로부터 접근하여 새로운 진단 방법, 약물 표적점 및 예후 중재 수단을 찾는 것이 매우 필요하다. 연구팀은 미토콘드리아의 주요 탈아세틸화 효소 SIRT3가 포도당 결핍 상황에서 단일 탄소 단위 대사 경로의 핵심적 대사효소인 세린히드록시메틸기전이효소2(SHMT2)와 직접 결합할 수 있고 또한 SHMT2 K95의 아세틸화 수식을 제거할 수 있어 SHMT2의 세포 내 발현을 안정시킴과 함께 고활성을 유지시킴을 발견하였다. SHMT2는 주로 세포 내 세린과 글리신의 상호 전환을 관장한다. 고활성 SHMT2는 세포를 도와 미토콘드리아의 활성산소 스트레스를 저항할 뿐만 아니라 세포내 생물 대분자 공급을 보장함으로써 암세포 쾌속 증식의 수요를 만족시킨다. 연구 결과 결직장암 환자 샘플에서 SIRT3과 SHMT2는 함께 고발현하였고 이는 SHMT2 K95의 아세틸화 수준을 상응하게 낮추었다. SIRT3 또는 SHMT2 고발현 결직장암 환자는 수술 후 전반적으로 생존율이 낮았고 예후도 나빴다. SHMT2 K95에 대한 아세틸화 수식은 E3 연결효소 TRIM21의 결합을 촉진시켰고 또한 아세틸화 SHMT2의 K63 폴리유비퀴틴 의존성 거대자가포식 경로를 통한 분해를 초래하였다. 상기 수식은 결직장암 세포의 증식속도와 종양형성 능력도 약화시켰다. 생쥐 장염 모델에서 Sirt3 유전자 결실은 생쥐 소장의 종양 크기와 수량을 유의하게 감소시켰다. 면역조직화학염색 결과 Sirt3 녹아웃 생쥐 종양세포에서 SHMT2 발현량은 뚜렷하게 감소되었다. 연구팀은 SHMT2 변이체 구조 해석을 통해 SHMT2 K95가 R/Q로 변이하여 SHMT2의 완전한 기능성 사합체 구조를 파괴해 기질 세린에 대한 친화성을 낮춤으로써 효소의 활성을 떨어뜨린다는 것을 발견하였다. 해당 연구는 결직장암 발생에서 SIRT3-SHMT2 조절축의 역할을 규명함으로써 SIRT3-SHMT2 조절축 표적지향성 결직장암 치료약물 개발에 이론적 토대를 마련하였다. 정보출처 : http://news.sciencenet.cn/htmlnews/2018/10/419319.shtm |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
