| 칭화대, 최초로 ABCA1의 삼차원 구조 해석 | ||
|
||
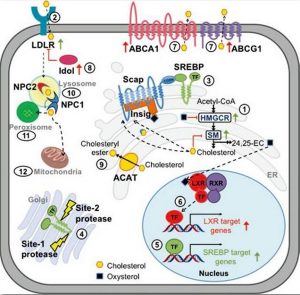 최근, 칭화대학 생명과학학원 구조생물학 첨단혁신센터 옌닝(顔寧) 연구팀은 동결전자현미경을 사용하여 원자 해상도에 가까운 콜레스테롤 역수송 과정의 핵심 단백질인 ABCA1 구조를 해석함으로써 ABCA1의 작용기전 및 관련 질병의 발병 메커니즘을 이해하는데 중요한 토대를 마련하였다. 해당 연구 논문은 ‘Structure of the Human Lipid Exporter ABCA1’란 제목으로 2017년 6월 8일 학술지 ‘Cell’에 온라인으로 게재되었다. 고급동물의 다양한 조직세포에 광범위하게 존재하는 콜레스테롤은 세포막, 혈장지질단백질의 주요 구성성분일 뿐만 아니라 콜산, 비타민 D, 스테로이드호르몬 등 다양한 특수 생리활성 분자의 전구체 화합물이다. 하지만 인체 내 과도한 콜레스테롤 축적은 죽상동맥경화증의 발생과 진행을 촉진시킬 뿐더러 관상동맥질환, 중풍 등 심각한 심뇌혈관질환을 유발할 수 있다. 인체 건강에 대한 콜레스테롤의 양면성 원인으로 세포 내 콜레스테롤의 항상성(cholesterol homeostasis) 조절은 인체건강을 지키는데 필수적이다. 저밀도 지질단백질 수용체 유도에 의한 콜레스테롤 섭취, 아세틸조효소A를 원료로 하는 콜레스테롤 합성, SREBP/SCAP/Insig 신호통로 유도에 의한 콜레스테롤대사 전사조절, NPC1/NPC2 유도에 의한 세포 내 콜레스테롤 수송, ABCA1/ABCG1 유도에 의한 콜레스테롤 역수송(reverse cholesterol transport) 등을 포함한 세포 내 콜레스테롤 항상성은 일련의 엄격한 제어를 받는 과정이다(그림 1). 연구팀은 콜레스테롤대사 조절 통로에 대한 체계적 구조생물학 및 생화학적 연구를 통해 마이코박테리아 내 콜레스테롤 감지 단백질 Insig 상동단백질의 결정구조(Ren et al., Science, 2015), 분열효모 SREBP와 SCAP 각각의 C말단 가용성 도메인의 결정구조 및 가용성 도메인 복합체의 동결전자현미경 구조(Gong et al., Cell Research, 2015; Gong et al., Cell Research, 2016), 인간유래 콜레스테롤 세포 내 수송단백질 NPC1의 동결전자현미경 구조(Gong et al., Cell, 2016)를 연이어 해석하였다. 콜레스테롤 역수송이란 간 외의 조직세포 내 콜레스테롤을 혈액순환을 통해 간으로 돌려보낸 다음 간에서 대사 전환을 거쳐 다시 체외로 배출하는 과정이다. 콜레스테롤 역수송을 통해 과다콜레스테롤을 동맥 혈관벽세포에서 체외로 배출시켜 포말세포의 형성을 저지함으로써 주상동맥경화의 발생과 진행을 억제시킬 수 있다. 콜레스테롤 역수송 과정의 첫 단계는 ABCA1이 인지질 및 콜레스테롤을 포함한 지질류를 세포 밖으로 수송한 다음 세포 밖 지질류 수용체 아포지질단백질 A-I(apolipoprotein A-I, apoA-I)과의 결합을 통해 인체에 유익한 신생 고밀도지질단백질(nascent HDL)을 형성한다. 여기서 지질류 배출 및 apoA-I과의 결합은 HDL를 형성하는 율속단계(rate-limiting step)이다. 기존 연구에 따르면 인체 내 ABCA1 돌연변이는 탄지에르병(Tangier disease), 가족성 HDL 결핍증(familial HDL deficiency) 등 HDL 결핍증을 유도할 수 있다. ABCA1이 콜레스테롤 역수송 과정에서의 핵심 단백질이고 주상동맥경화 등 질병 발생과 진행 과정에서 핵심적 역할이 밝혀졌지만 현재 ABCA1 구조 및 ABCA1 유도에 의한 지질류 외향성 수송 및 신생 HDL 형성 메커니즘은 밝혀지지 않았다. 이번에 게재된 논문에 따르면 인간유래 ABCA1 전장 단백질의 전체 구조는 4.1옹스트롬(angstrom)이고 핵심 세포외영역 도메인은 3.9옹스트롬이다. ABC (ATP-binding cassette) 슈퍼패밀리에 속하는 ABCA1의 고해상도 구조를 획득한 것은 ABCA 서브패밀리에서는 이번이 처음이다. 아울러 구조 해석을 통해 매우 특이한 세포외영역 도메인을 보유하였음을 발견하였다. 즉, ABCA1 핵산결합 도메인(nucleotide-binding domain, NBD)은 핵산과 결합하지 않은 상태였지만 막관통영역은 의외로 ‘외향성 개방(outward-facing)’ 상태를 드러내고 있었다. 이는 기존에 보고된 모든 ABC 외향성 수송단백질이 핵산과 결합하지 않은 경우 모두 내향성 개방(inward-facing) 상태였던 것과 구별된다. 또한 ABCA1의 세포외영역은 매우 독특한 구조로 형성되었고 그 가운데 1개 긴 소수성 터널(elongated hydrophobic tunnel)을 포함하고 있었다. 이 같은 구조 발견은 심층적인 기능 연구를 위해 핵심적 실마리를 제공하였다. 뿐만 아니라 ABCA1 고해상도 구조 획득은 기존에 밝혀지지 않은 대량 돌연변이에 의한 질병 발병 메커니즘을 이해하는데 중요한 기반을 마련하였다. 연구팀은 상기 구조 분석을 토대로 ABCA1 유도에 의한 인지질의 외향성 수송에 대한 측방향 진입(lateral access) 수송 모델을 제시하였다. 해당 모델은 기존의 대부분 능동 수송단백질 및 2차 수송단백질에 이용되던 교호수송(alternating access) 모델과 구별된다. 교호수송 모델에서 수송단백질의 막관통영역은 수송 과정에서 외향성 개방과 내향성 개방의 교체적 출현을 필요로 하여 기질을 세포막의 한 쪽에서 다른 쪽으로 수송한다. 그러나 ABCA1의 측방향 진입 모델에서 막관통영역이 ‘외향성 개방’ 상황에 처해있더라도 기질은 세포막의 내엽(inner leaflet)에서 막관통영역의 기질결합포켓(Substrate binding pocket)에 측방향 진입할 수 있다. 그러므로 ABCA1 수송 과정에 ‘내향성 개방’ 상태가 존재하지 않을 수 있다(그림2). 한마디로 정리하면 ABCA1 구조 해석을 통해 작용 메커니즘 및 관련 질병의 발병 메커니즘을 이해하는데 중요한 기반을 마련하였고 또한 막관통 수송단백질의 작동 메커니즘에 대한 이해를 넓혔다. 정보출처 : http://news.sciencenet.cn/htmlnews/2017/6/378809.shtm |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
