| PKM2가 Bcl2 안정화로 세포사멸을 억제 | ||
|
||
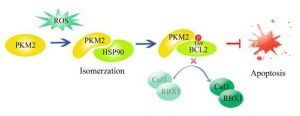 최근, 중국과학원 상하이생명과학연구원 생화학·세포생물학연구소 양웨이웨이(楊巍維) 연구팀은 세포산화 스트레스 조건에서 PKM2가 Bcl2 안정화를 통해 세포사멸을 억제하는 새로운 메커니즘을 규명하였다. 연구 성과(Mitochondrial PKM2 regulates oxidative stress-induced apoptosis by stabilizing Bcl2)는 국제학술지 ”Cell Research” 온라인으로 발표되었다. PKM2(Pyruvate kinase M2 isoform)는 당분해 경로의 핵심효소로서 종양세포의 발생·발전 과정에서 중요한 작용을 한다. 기존 연구에 따르면, PKM2는 대사활성 외 단백질인산화효소 활성도 가지고 있다. 양웨이웨이 연구팀은 예비 연구에서 EGFR 활성화 조건에서 PKM2는 세포핵으로 이동할 수 있고 히스톤 H3을 인산화하며 후성유전학적 방법으로 일련의 원암유전자 발현을 조절한다는 것을 발견하였다(Nature 2011,Cell 2012). 최근에 발표된 다른 보고서에서는 PKM2가 세포증식 뿐만 아니라 종양세포의 항세포사멸 과정에도 작용한다고 보고되었지만 그 작용 메커니즘은 밝히지 못했다. 양웨이웨이 연구팀의 최신 연구에 따르면, 산화 스트레스 조건에서 세포질 내 PKM2는 샤페로닌 HSP90과 상호작용하여 구조 변화를 발생할 수 있다. 구조가 개변된 PKM2는 미토콘드리아로 이동하여 Bcl2와 상호작용하는데 이 과정에서 Bcl2의 69번째 트레오닌을 인산화시킨다. 이러한 인산화는 Bcl2와 Cul3 유비퀴틴연결효소의 결합을 차단하여 Bcl2 단백질 수준을 안정시킴으로써 산화 스트레스에 의한 세포사멸을 억제한다. 세포 및 동물실험을 통해 PKM2 유도 Bcl2 인산화는 신경교종의 발생·발전에서 중요한 작용을 한다는 것을 검증하였다. 임상샘플 분석 결과, Bcl2 인산화 수준은 신경교종 환자의 등급 구분 및 예후와 밀접한 연관이 있는 것으로 나타났다. 연구팀의 량지(梁冀) 부연구원과 차오루이슈(曹銳修) 박사연구생이 본 논문의 공동 제1저자로 참여하였고 연구자료 수집작업은 생화학·세포생물학연구소 공공기술서비스센터의 분자 플랫폼, 세포 플랫폼, 동물 플랫폼에 기반하였으며 연구과제는 중국공산당 중앙조직부, 국가과학기술부, 국가기금위원회의 지원을 받았다. 타이틀 이미지: 종양세포에서 산화 스트레스는 PKM2의 이성질체화를 자극하는데 이 과정에 HSP90의 도움을 받는다. 그 다음 미토콘드리아로 이동하여 Bcl2의 69번째 트레오닌 인산화하며 이를 통해 Cul3-RBX1과 Bcl2의 결합을 차단함으로써 Bcl2의 단백질 수준을 안정시켜 세포사멸을 억제한다. 정보출처 : http://www.stcsm.gov.cn/xwpt/kjdt/348540.htm |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
