| 상하이생명과학연구원, 선천면역 신호경로 조절 메커니즘 최신 연구성과 | ||
|
||
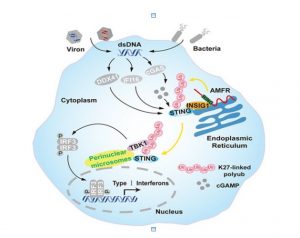 중국과학원 상하이생명과학연구원(上海生命科學研究院) 생화학·세포생물학연구소의 왕천(王琛) 연구진이 AMFR/INSIG1 화합물이 세포질 DNA 자극에 의해 유도된 선천면역 신호경로를 특이적으로 조절할 수 있음을 발견하고, 하위 TBK1 키나아제를 활성화시키는 STING의 새로운 분자 메커니즘을 규명하였다. 관련된 연구논문은《The E3 Ubiquitin Ligase AMFR and INSIG1 Bridge the Activation of TBK1 Kinase by Modifying the Adaptor STING》라는 제목으로 2014년 12월 18일자 “Immunity”지에 게재되었다. 선천면역은 숙주가 병원체의 침입을 방어하는 첫번째 방어선이다. 숙주는 Toll 유사 수용체(Toll like receptor, TLR), RIG-I 유사 수용체(RIG-I like receptor, RLR) 및 DNA 인식 수용체 등과 같은 생식세포유전자 코드 형태의 인식 수용체(pattern recognition receptor, PRR)를 통해 세균의 지질다당체와 바이러스의 핵산 등 병원체 관련 분자를 인식하여 병원균의 침입을 인지한 후, 관련 세포의 신호전달을 통해 중요한 전사인자(핵인자 κB 및 인터페론 조절인자)를 활성화시키고 I형 인터페론(Type I Interferon) 및 염증인자의 발현을 유도하는 동시에 적응성 면역반응을 유도하여 궁극적으로 병원균을 사멸시킨다. DNA 수용체는 DNA를 인식한 후, 신호를 소포체에 있는 노드 분자 STING에 전달한다. STING은 신속히 2합체를 형성하여 소포체로부터 골지체를 거쳐 핵주위 소구체로 전이한다. 이와 동시에 TBK1도 핵주위 소구체에 밀집된다. DNA 자극에 의해 촉진되는 STING-TBK1 화합물의 밀집 현상은 TBK1 활성화에 필수적인 것이며, 활성화 후의 TBK1은 IRF3를 인산화시킨다. 그 후, IRF3은 2합체를 형성하고 핵이동을 통해 표적 유전자를 발현시킨다. STING과 TBK1이 동시에 핵주위 소구체에 밀집되는 분자 메커니즘은 아직 밝혀지지 않았다. 왕창(王強) 박사과정생과 류싱(劉星) 박사후과정생은 단백질체학 기법을 이용하여, AMFR/INSIG1이 STING의 동적 화합물을 구성하는 부분이라는 것을 선별하고 감정했다. E3 유비퀴틴 접합단백질 AMFR(autocrine motility factor receptor) 혹은 INSIG1(Insulin induced gene 1) 결실 세포에서 세포질 DNA의 자극과 STING에 의해 유도된 항바이러스 유전자의 발현은 뚜렷하게 감소했다. 상기 결과와 일치한 부분은, 골수성 세포에서 INSIG1을 특이적으로 녹아웃한 쥐가 야생 쥐에 비해 HSV-1 바이러스에 더 쉽게 감염된다는 점이다. 분자 메커니즘에 대한 심층 연구를 통해 AMFR이 STING에 K27 사슬형 유비퀴틴 변형이 발생하도록 촉매작용을 한다는 것을 밝혔다. 해당 유비퀴틴 사슬은 분자 플랫폼으로서 TBK1을 수집한 후, TBK1을 핵주위 소구체에 이동시킨다. 최근 몇 년 동안, 왕천 연구팀은 TLR, RLR 및 DNA 수용체로 유도한 선천면역 신호경로 조절 분야를 체계적으로 연구하여 아래와 같은 단계적 진전을 얻었다. 조절에 참여하는 여러 개 새로운 분자(UXT, Trim21, Herc5, Tom70, IFIT3, Cited2, MARCH5, SENP6 등)가 각각 신호경로의 다양한 측면을 조절한다는 것을 발견했다. 인산화, 유비퀴틴화, ISG15화, SUMO화 등 여러 단백질의 번역 후 변형이 선천면역 반응 신호경로에서의 조절작용을 제시했다. 일부 연구결과는 이미 해당 작업을 완성하는 과정에 우한(武漢)대학 쑹바오량(宋保亮), 중국과학원 상하이파스테르연구소 렁치빈(冷啟彬), 상하이생명과학원 건강과학연구소 쳰유춘(錢友存) 연구원, 쑤저우(蘇州)대학 정춘푸(鄭春福) 교수, 난카이(南開)대학 차오원타오(喬文濤) 교수 등 중국 내외 연구팀의 지원과 도움을 받았다. 이번 연구는 국가과학기술부, 자연과학기금위원회, 중국박사후연구프로젝트기금, 중국과학원 상하이생명과학연구원 박사후연구프로젝트기금 등의 지원을 받았다. 정보출처 : http://www.cas.cn/syky/201412/t20141225_4282070.shtml |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
