| 칭화대학 스이궁 교수 연구팀, 최대 이온통로 RyR1 구조 규명 | ||
|
||
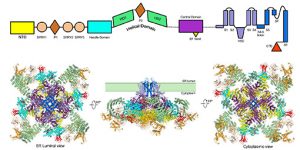 2014년 12월 15일, 중국 칭화대학교 의학대학 옌닝(颜宁) 연구팀과 생명대학 스이궁(施一公) 연구팀, 영국 MRC분자생물학실험실 Sjors Scheres 연구팀은 협력하여 “Structure of the rabbit ryanodine receptor RyR1 at near-atomic resolution”(토끼 RyR1의 Near-atomic resolution 구조)라는 논문을 <네이처>지에 온라인상으로 발표하여 최대 이온통로인 Ryanodine 수용체 RyR1의 3차원 구조를 밝힘으로써 그 기능을 연구하는데 중요한 단서를 제공하였다. Ryanodine 수용체(Ryanodine Receptor, 약칭 RyR)는 고 처리율 칼슘 이온 통로로서 칼슘 이온을 근소포체로부터 세포질로 빠르게 대량 방출시킨다. RyR은 사량체(tetramer) 형태로 그 기능을 발휘하며 한 가지 개체에는 5,000개 이상의 아미노산이 존재한다. 포유동물에는 3가지 RyR 단백질이 존재하며 그중 RyR1은 주로 골격근 세포 내에 분포되어 있고 RyR2는 심근세포 내에 분포되어 있으며 RyR3은 뇌 세포에서 가장 최초로 발견되었다. 세가지 단백질의 서열은 모두 매우 보수적이다. RyR의 돌연변이체는 중심핵병(central core disease, CCD), MHS(malignant hyperthermia susceptibility) 등 질병을 유발할 수 있다. 많은 문헌 보고의 통계에 따르면 현재 500여 종의 RyR 돌연변이가 질병과 관계된다. RyR은 20세기 70년대에 최초로 발견되었으며 80년대부터 약 40년간 RyR에 대하여 체계적인 연구를 진행하였다. 옌닝 연구팀과 스이궁 연구팀은 영국 MRC의 Sjors Scheres 교수와 협력하여 새로운 단백질 순화 방안을 탐색하여 양질의 단백질 샘플을 얻었다. 또한 단일 입자 저온전자현미경방법으로 토끼의 RyR1 단백질과 억제 단백질 FKBP12 복합물의 3차원 구조를 해석하는데 성공하였다. 이번 연구는 근육 수축 연결 및 관련 질병을 인식하는데 큰 의미가 있을 뿐만 아니라 관련 질병을 치료하는데 주요한 구조적 단서를 제공하였다. 정보출처 : http://news.sciencenet.cn/htmlnews/2014/12/309716.shtm |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
