| 아레나바이러스 복제 조절 메커니즘 규명 | ||
|
||
 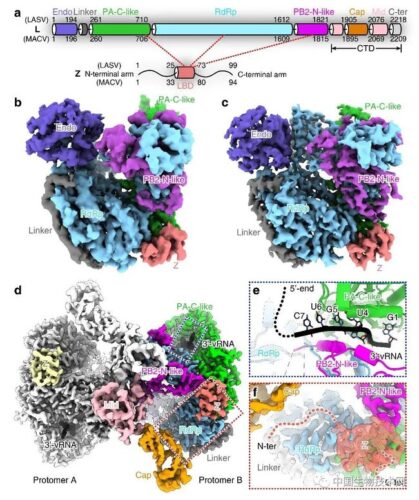 중국과학원 미생물연구소의 Shi Yi(施一) 연구원은 협력기관과 공동으로 저온전자현미경을 이용하여 두가지 아레나바이러스-라사바이러스와 마츄포바이러스의 L중합 효소단백질과 그에 상응하는 기질 단백질 Z의 복합물 구조를 분석하고 Z 단백질이 중합효소 활성을 음성 조절하는 메커니즘을 규명했다. 해당 연구 성과는 국제학술지 “Nature Microbiology”에 게재되었다. 아레나바이러스의 복제 메커니즘을 체계적으로 연구하기 위해 연구팀은 기존 연구에서 올드(Old) 아레나바이러스군과 뉴(New) 아레나바이러스군의 대표 바이러스인 라사바이러스와 마츄포바이러스 중합효소의 정밀 3D 구조를 분석했다. 구조 분석과 생화학 실험을 통해 아레나바이러스 중합효소의 효소 활성 중심이 자연적으로 열린 활성 구조에 있음을 발견했다. 또한 중합효소와 RNA의 식별 모드를 규명했으며, L 중합효소 자체 이합체화의 복제 및 전사 활성에 대한 조절 작용을 초보적으로 밝혔다. 해당 발견은 다양한 아레나바이러스의 진화적 연결과 차이점을 이해하기 위한 핵심 정보를 제공했으며 또한, 아레나바이러스 중합효소를 표적으로 하는 약물 설계를 위한 새로운 후보 타깃을 제공했다. 관련 연구 성과는 2020년에 국제학술지 “Nature”에 발표되었다. 해당 연구를 기반으로 연구팀은 아레나바이러스 기질 단백질 Z가 중합효소 활성을 음성 조절하는 분자 메커니즘을 심층 연구했다. 저온전자현미경을 이용하여 라사바이러스와 마츄포바이러스 중합효소 L 단백질과 이에 상응하는 기질 단백질 Z의 복합물 구조 및 L-Z 이원 복합체와 3'-vRNA 결합의 삼원 복합체 구조를 분석했다. 구조에 따르면, 각 복합체 쌍에서 1개의 Z 단백질이 단량체 형식으로 1개의 중합효소에 결합되고 결합 부위는 중합효소의 “손바닥 구조 영역” 외곽에 위치하며 RNA 결합 부위에서 멀리 떨어진다. 이는 Z 단백질 결합 후에 중합효소의 RNA 템플릿 “모집”에 영향을 주지 않으며 Z 단백질이 알로오스테리 효과를 통해 중합효소 활성을 음성 조절할 가능성이 있음을 시사한다. 연구팀은 또한 Z 단백질이 중합효소의 두 촉매 모티프의 말단에 결합됨을 발견하고 두 촉매 소자의 RNA 합성 과정에서의 구조 변화를 방해하여 중합효소가 촉매 활성을 상실하게 한다고 추정했다. 수소-중수소 교환 질량분석 실험을 이용하여 해당 가설을 입증했다. 연구팀은 또한 Z 단백질이 중간 구조 도메인을 통해 L 단백질에 결합하고 고도로 보수적인 소수성 루프가 L 중합효소 단백질과의 상호작용을 지배함을 발견했다. 결합 모티프가 고도로 보수적이기 때문에 라사바이러스와 마츄포바이러스 Z 단백질과 L 단백질이 체외에서 교차 억제 효과를 나타낼 수 있음을 관찰했다. 해당 현상은 올드 및 뉴 아레나바이러스 Z 단백질이 L 단백질 RNA 합성을 조절하는 보수적인 메커니즘을 나타낸다. 해당 발견은 중합효소를 표적으로 하는 광역 항바이러스 약물 설계를 위한 새로운 방향을 제공하고 중합효소의 보수성 기능 모티프의 구조 변화를 억제함으로써 광역 억제제를 개발할 수 있음을 시사한다. 정보출처 : https://www.cas.cn/cm/202106/t20210615_4793113.shtml |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
