| P450 효소의 전체 길이 구조 규명 | ||
|
||
 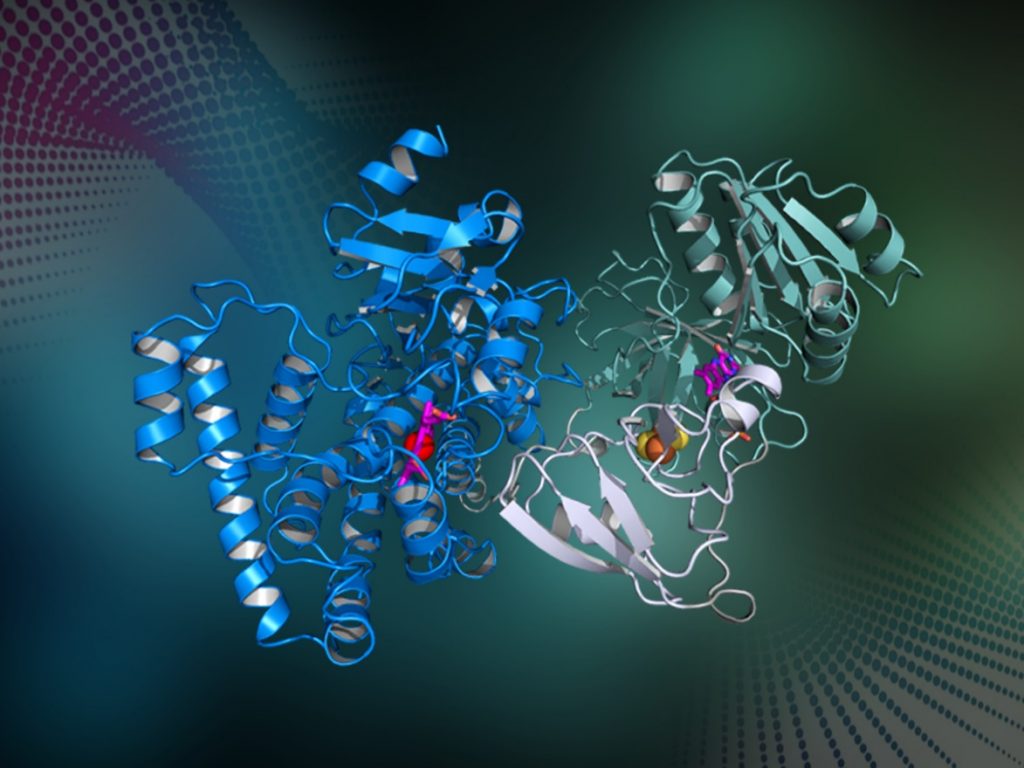 후베이(湖北)대학교 생명과학대학 성부(省部)공동구축 생물촉매·효소공학 국가중점실험실 천춘치(陳純琪)/마리신(馬立新)/궈루이팅(郭瑞庭) 연구팀은 환원효소 영역에서 전자(Electronic)가 기질 결합 영역에 진입하는 반응 메커니즘을 규명함으로써 P450 효소의 완전한 촉매작용 메커니즘 연구에서 중요한 성과를 거두었다. 해당 성과는 "Nature Communications"에 게재됐다. "적색 만능효소"로 불리는 P450 효소는 헴(Heme)을 함유하고 있을 뿐만 아니라 히드록실화, 에폭시화, 탈알킬화, 탄소-탄소 커플링, 산화 분해 등 다양한 반응에서 촉매작용을 일으키며 또한 효소 촉매작용을 통해 약물 및 화학품 생산으로 초래된 환경오염 문제를 해결할 수 있다. 그러나 수십 년이 지난 지금에도 P450 효소의 결정구조는 해석되지 않았고 촉매작용 메커니즘도 파악하지 못했다. 연구팀은 내열성 균에서 유래된 "자급자족 P450 효소"를 찾아냈다. 해당 P450 효소는 70℃ 고온에서도 매우 안정적이고 절단 및 분해되지 않기에 매우 쉽게 결정화된다. 연구팀은 X선 결정학적 기술로 "자급자족 P450 효소"의 고해상도 전체 길이 구조를 성공적으로 해석했다. 연구를 통해 연구팀은 유전자 시퀀스의 정렬 순서가 헴 결합 영역-환원효소 구조 도메인-페레독신 구조 도메인인 전체 P450 효소의 3개 구성 요소를 발견했다. 해당 3개 영역은 각각 1개의 보조인자를 갖고 있으며 3개 보조인자는 P450 효소 내부 전자 전달의 "중계 스테이션" 역할을 담당한다. 결정구조를 연구한 결과, 헴 결합 영역과 환원효소는 각각 전체 단백질의 양단에 위치해 있고 헴 결합 영역은 외부 방향으로 향함과 아울러 개구부를 노출함으로써 기질의 진입이 편리하며 전자는 여러 개의 "중계 스테이션"을 경과하여 최종적으로 헴에 전달되어 효소 촉매반응에 참여한다. 연구팀은 중간에서 매우 많은 아미노산을 관찰함과 아울러 그 중의 여러 개 아미노산은 P450 효소의 전자 전달에 매우 중요함을 입증했다. 이는 지금까지 세계에서 최초로 해석한 "자급자족 P450 효소"의 전체 길이 3차원 구조로서 기타 다양한 P450 효소의 개선 및 응용에 중요한 지시적 의미가 있다. 연구팀은 이미 획득한 구조학적 정보를 이용해 P450 효소에 대한 심층적인 설계 개선을 가속화하여 더욱 많은 중요한 반응에서 촉매작용을 일으키는 새로운 효소를 개발하고 P450 효소를 친환경 생물학적 공법으로 제조함과 아울러 생물 과학기술, 제약공학 및 화학공학 산업에서 응용을 달성하기 위해 노력하고 있다. 정보출처 : http://stdaily.com/index/kejixinwen/2020-05/29/949749/images/d70334288eff4b1d94c65bae36d9f254.jpg 정보출처 : http://news.sciencenet.cn/htmlnews/2020/6/441813.shtm |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
